Orale Dysbiose und Allgemein-Erkrankungen - Teil 1: Ätiologie und therapeutische Bedeutung
Quintessenz für das Praxisteam
Parodontitis ist Folge einer subgingivalen Dysbiose, eines gestörten Gleichgewichts im Biofilm. Ein dysbiotischer Biofilm ist einerseits Risikofaktor für eine Endokarditis und Pneumonie. Andererseits ist Parodontitis ein Risikofaktor für eine Reihe systemischer Erkrankungen. Dazu gehören Typ-2-Diabetes, kardiovaskuläre, Atemwegs- und neurodegenerative Erkrankungen und Krebs. Patienten mit Typ 2 Diabetes haben durch eine Parodontitis-Behandlung einen signifikanten Nutzen. Umgekehrt können sich einige systemische auch auf orale biofilm-induzierte Erkrankungen auswirken. Entsprechend benötigen betroffene Patienten eine enge interdisziplinäre Zusammenarbeit mit internistischer Medizin und anderen Fachgebieten.
Zusammenfassung
Eine orale Dysbiose lässt sich als pathologische Veränderung des Mikrobioms beschreiben, mit komplexer Verbindung zur Immunantwort. Dieser Beitrag erläutert aktuelle Konzepte für den Übergang von einem symbiotischen in einen dysbiotischen Zustand und dessen Rolle bei oralen Erkrankungen, insbesondere in Bezug auf Parodontitis. Er benennt weiterhin wichtige „allgemeine“ Erkrankungen, die mit oraler Dysbiose und chronischer Entzündung zusammenhängen. Schließlich informiert er über therapeutische Auswirkungen eines oralen Dysbiose-Managements auf diese Erkrankungen.
Orales Mikrobiom als Ökosystem
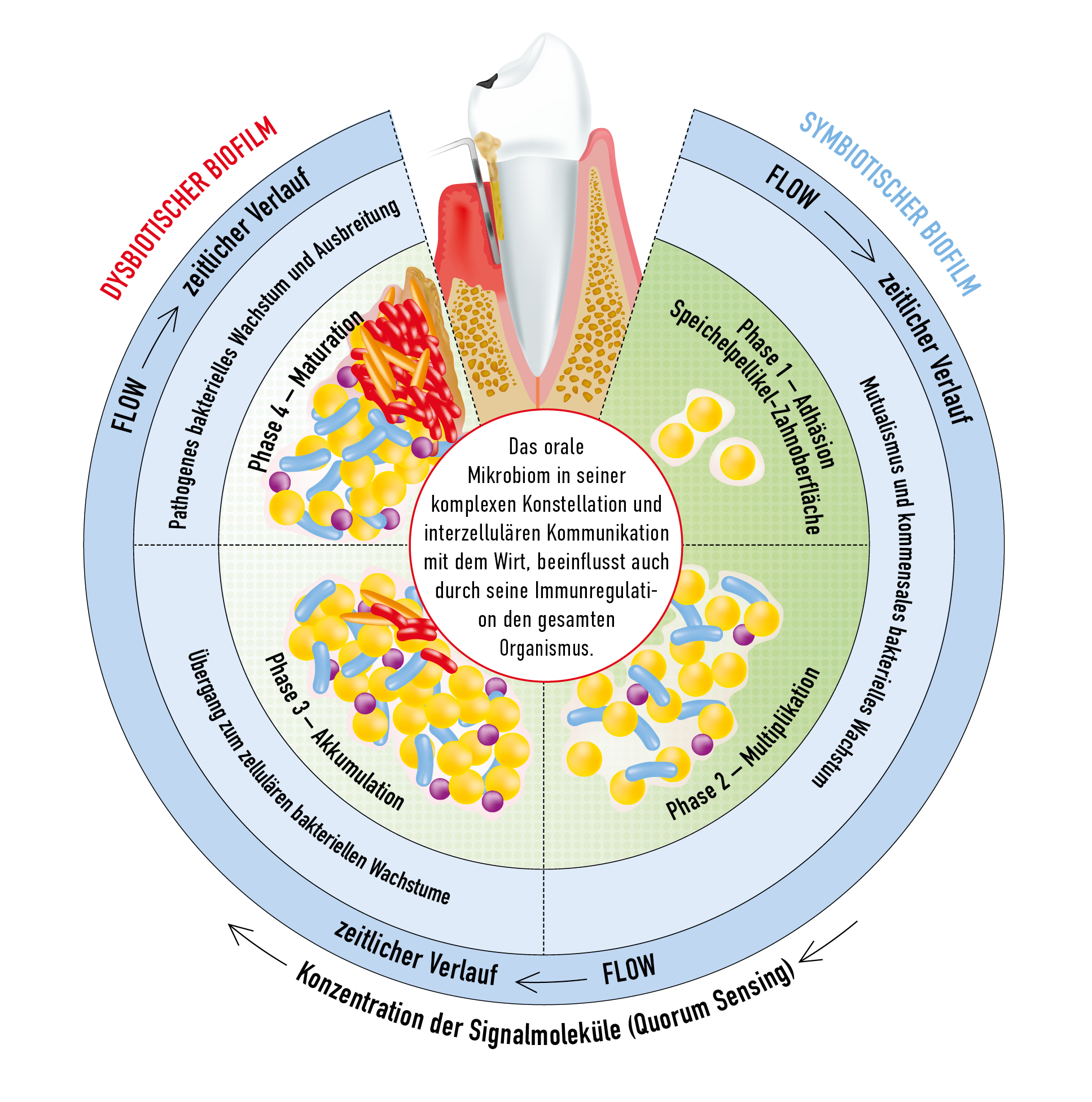
Zwischen der mikrobiellen Lebensgemeinschaft und oralen Geweben besteht im gesunden Zustand ein Gleichgewicht (1, 2). Dieses ist zum Teil symbiotisch, nützt also sowohl den Mikroorganismen als auch dem Wirt. Das gilt zum Beispiel für eine reduzierende Wirkung auf Nitrat, die für Bakterienarten aus den Gattungen Neisseria, Actinomyces und weiteren nachgewiesen wurde. Die entstehenden Stickoxide sind entzündungshemmend und begünstigen die kardiovaskuläre Gesundheit (3). Bestimmte Mikrobiom-„Ökotypen“ sind zudem im Vergleich zu anderen mit oraler Gesundheit vereinbar und helfen, diese zu stabilisieren (4, 5).
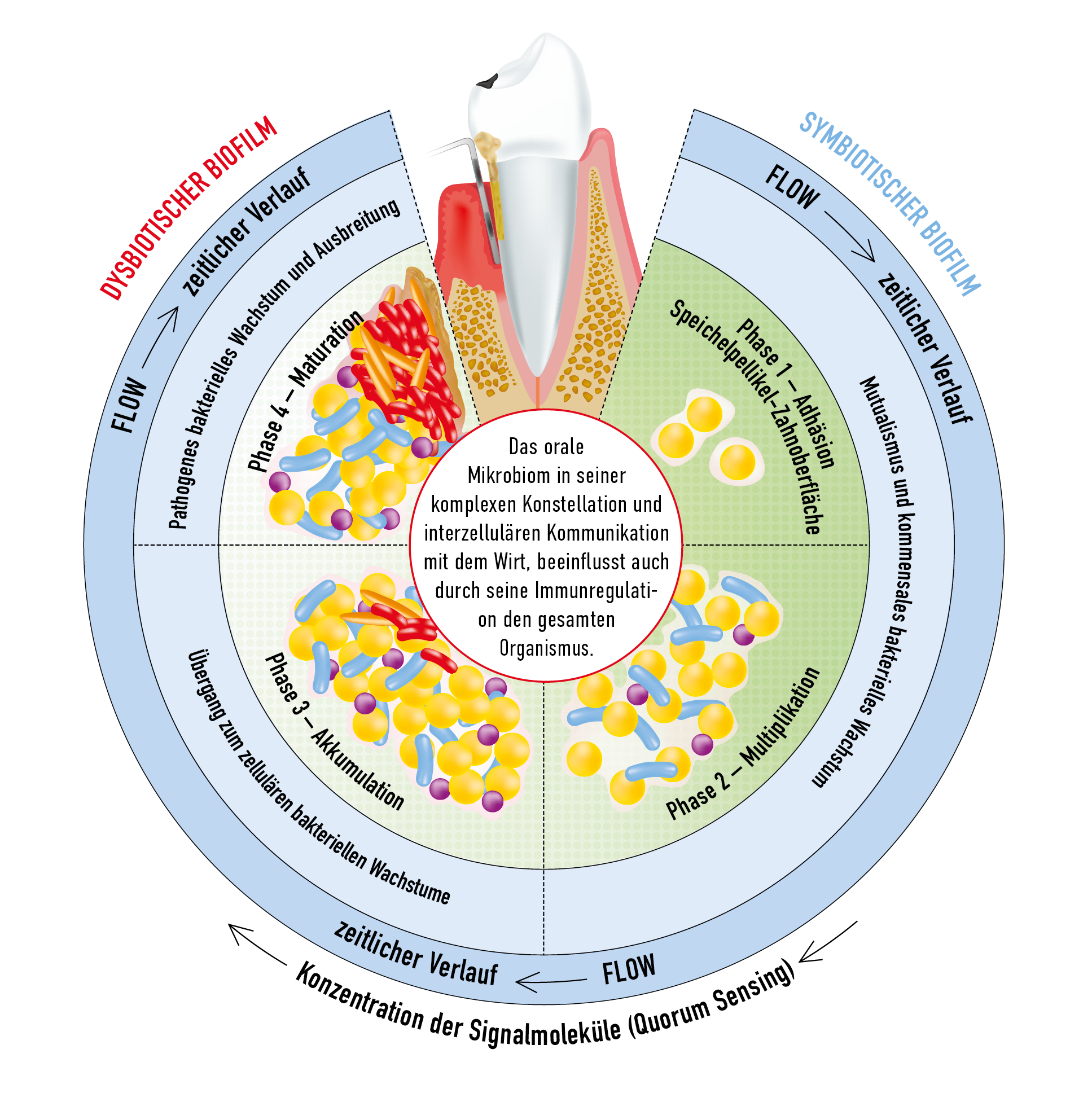
Ein gesundes Mikrobiom (Eubiose) geht bei Erkrankungen in ein pathologisch verändertes über und es etabliert sich eine so genannte Dysbiose (Abb. 1) (1). Diese kann mit einer Reihe von Faktoren assoziiert sein) oder durch sie verursacht werden (ätiologischer Zusammenhang). Dazu gehören eine schlechte Mundhygiene, ungünstige Ernährung, hormonelle Veränderungen infolge Schwangerschaft, mangelhafte Quantität oder Qualität des Speichels, Rauchen, Stress, systemische Erkrankungen und Antibiotika-Medikation (4, 6-11). Die Rolle genetischer Faktoren ist noch weitgehend ungeklärt (12, 13).
Fazit: Ein pathologisches orales Mikrobiom (Dysbiose) wird durch unzureichende Mundhygiene und weitere Risikofaktoren verursacht oder verstärkt.
Dysbiose und orale Erkrankungen
In Bezug auf Karies zeigt eine aktuelle prospektiv angelegte Untersuchung mit molekularbiologischen Analysemethoden (Next Generation Sequencing) dysbiotische Veränderungen bis zu drei Jahre vor Auftreten einer Läsion (14). Der Übergang in einen pathologischen Zustand erfolgt demnach langfristig, nicht wie bisher vermutet durch kurzfristige Änderungen zum Beispiel in der Ernährung oder Mundhygiene. Die dahinter stehenden molekularbiologischen Zusammenhänge sind noch unzureichend geklärt (15).
Für Gingivitis gibt es jedoch zunehmend Daten zu mikrobiellen, aber auch immunologischen Veränderungen im Gewebe (12, 16). Beim möglichen Übergang in eine Parodontitis ist das Gleichgewicht zwischen Mikrobiom und Wirtsantwort in pathologischer Weise gestört, was zu entzündlichem Abbau von Hart- und Weichgeweben führt (17, 18). Zeiträume für den Übergang in eine Dysbiose sind wahrscheinlich individuell unterschiedlich und von Risikofaktoren abhängig (siehe oben). Auch hier können aufgrund von Befunden aus der Therapie längere Zeiträume angenommen werden, die sich vor einer Parodontitis-Erstmanifestation und in der Nachsorge (UPT) unterscheiden (19).
Ein ursächlicher Zusammenhang wird auch zwischen Dysbiose und dem Auftreten von oralen Plattenepithelkarzinomen vermutet. Eine retrospektive Studie zeigte beides unabhängig von Kofaktoren wie Rauchen und Alkohol (20). Eine systematische Übersicht zur Rolle der Mundhygienequalität bei Patientinnen und Patienten mit Karzinomen im Kopf- und Halsbereich liefert ein weiteres Indiz für ätiologische Verbindungen (21). Das Mikrobiom auf der Oberfläche erkrankter Gewebe unterscheidet sich zudem zwischen Patientinnen und Patienten mit Plattenepithelkarzinomen und Gesunden (22). Eine charakteristische mikrobielle Zusammensetzung bei Erkrankten konnte aber nicht identifiziert werden, so dass die Befunde bisher nicht diagnostisch nutzbar sind.
Fazit: Karies und Parodontitis sind wahrscheinlich eine Folge spezifischer, längerfristiger mikrobieller Verschiebungen. Plattenepithelkarzinome haben ebenfalls ein verändertes Mikrobiom.
Orale Entzündung als Schnittstelle
Eine Wechselwirkung von Mikrobiom und Entzündung gilt als entscheidender ätiologischer Faktor nicht nur bei oralen, sondern auch bei vielen anderen chronisch-entzündlichen Erkrankungen im Körper (23, 24). So werden zunehmend Mechanismen beschrieben, die Parodontitis zum Beispiel mit kardiovaskulären Erkrankungen, Diabetes oder Krebs gemeinsam hat (25-27). Über den Blutweg (Bakteriämie) gelangen Mikroorganismen und Entzündungs-Mediatoren aus dem entzündeten Körperbereich in das Knochenmark, wo sie neben der lokalen angeborenen, auch eine adaptive (erworbene) Immunantwort auslösen (28). Diese verläuft über längere Zeiträume, spielt bei chronischen Erkrankungen eine zentrale Rolle und führt auch bei behandelter Parodontitis zu erhöhter Entzündungsneigung (29, 30).
Die bei Parodontitis je nach Schweregrad große Oberfläche entzündeter Gewebe fördert diese Vorgänge (31). Sie könnten ein ätiologisches Bindeglied zwischen oralen und systemischen Erkrankungen darstellen und die häufig „geteilte“ Prävalenz erklären (25). Bisher ist es aber je nach Erkrankung unklar, ob die Entzündung im Mundraum ein unabhängiger ätiologischer Faktor ist oder ob es sich um ein nicht-kausales Zusammentreffen (Assoziation) im Sinne einer allgemein erhöhten Entzündungsneigung im Körper handelt. Sicher nachweisbar ist eine kausale Beziehung nur mit Interventionsstudien, im Idealfall mit gut durchgeführten randomisiert-kontrollierten Studien (RCTs). Diese werden in der Regel von Kostenerstattern vor der Genehmigung neuer Versicherungsleistungen verlangt, sind aber aufwendig und können unter ethischen Gesichtspunkten anspruchsvoll durchzuführen sein.
Fazit: Chronisch-entzündliche Erkrankungen im Mund und übrigen Körper haben gemeinsame immunologische Merkmale. Diese könnten ein ätiologisches Bindeglied sein, das eine gemeinsam auftretende erhöhte Häufigkeit erklären hilft.
Orale und systemische Erkrankungen – klinische Evidenz
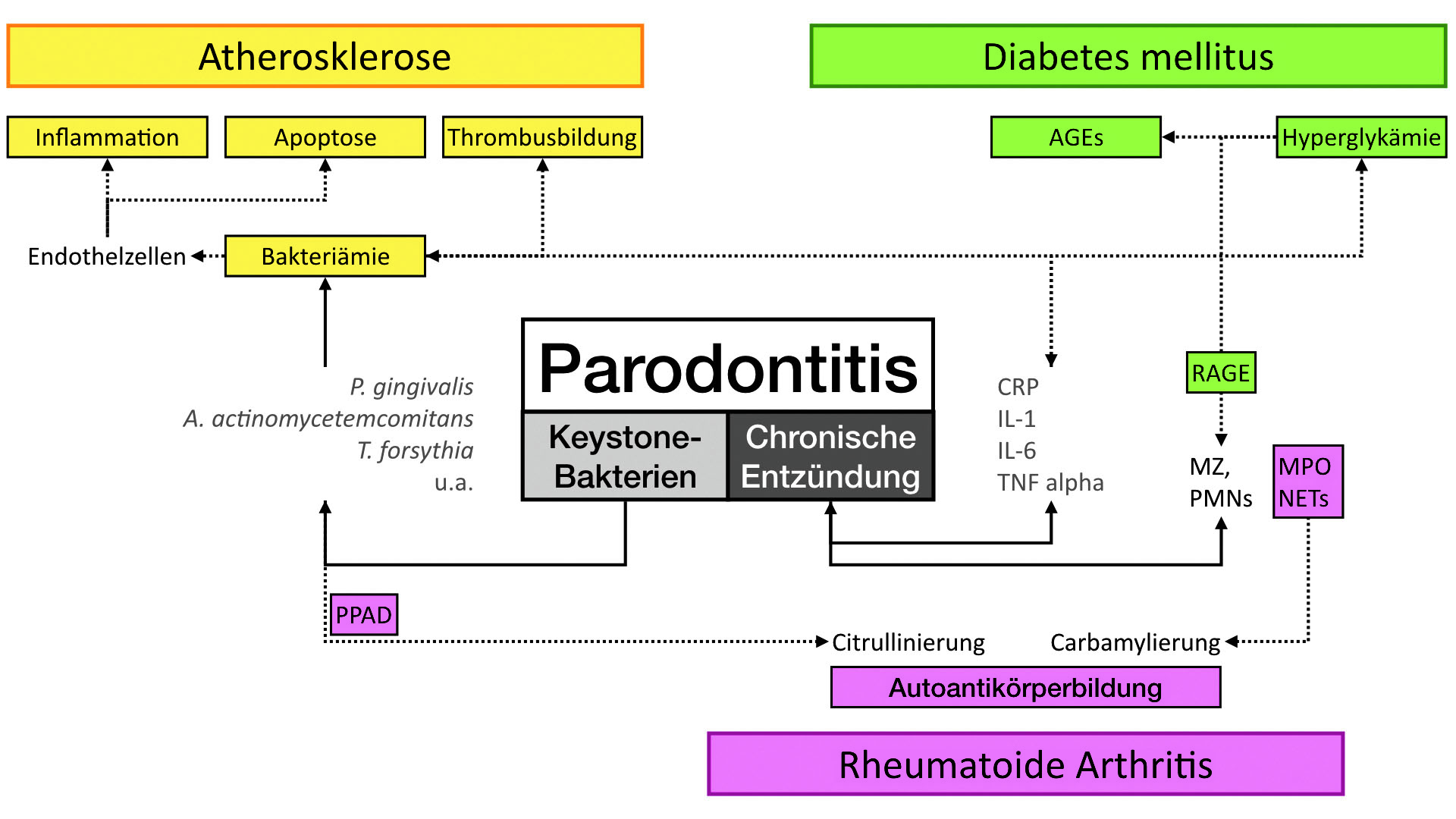
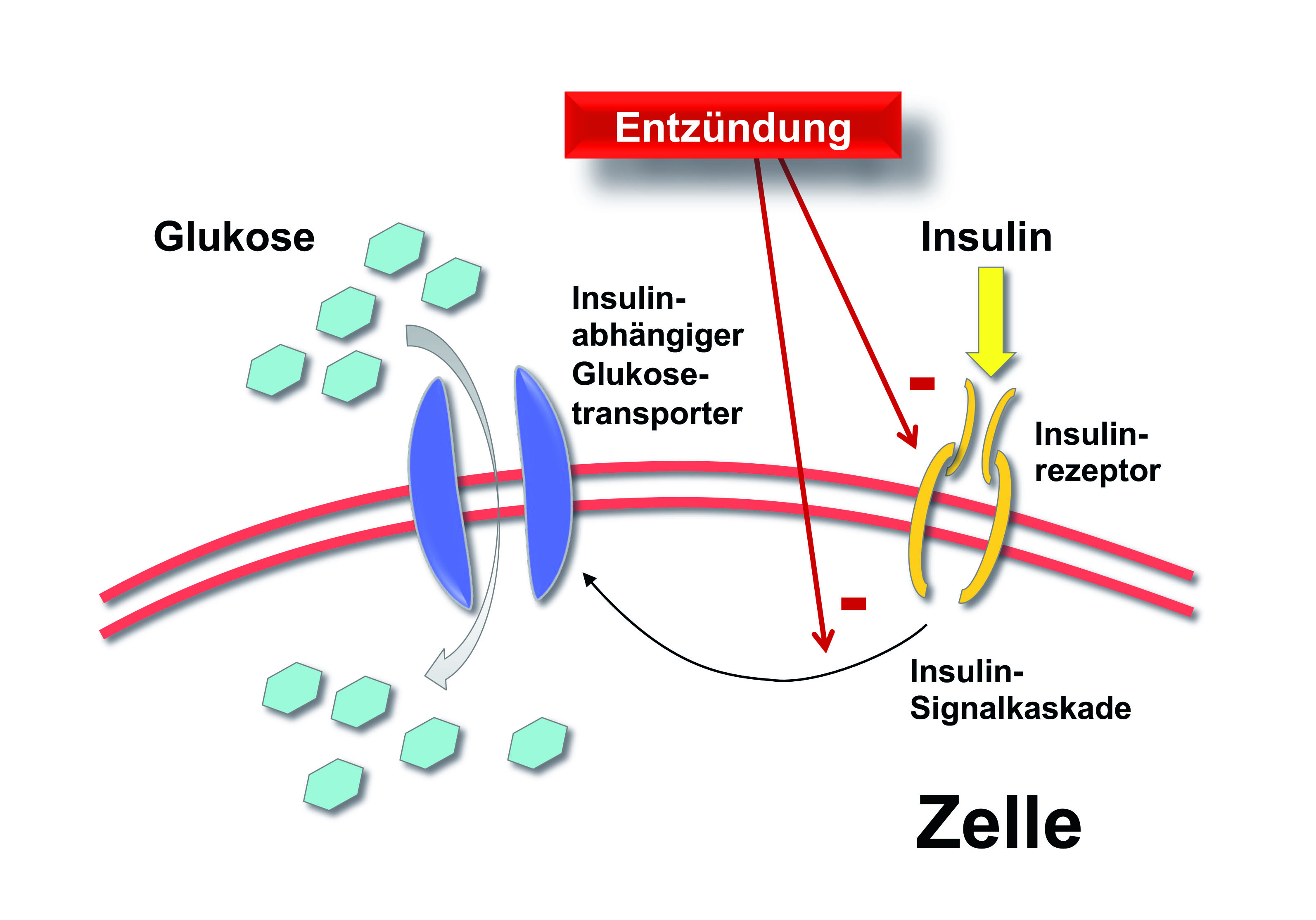
Eine aktuelle gemeinsame Konsens-Erklärung der European Federation of Periodontology (EFP, Wissenschaft) und der europäischen Teilorganisation der World Organization of Family Doctors (WONCA Europe, Berufsverband) definiert Diabetes Typ 2, kardiovaskuläre Symptomatiken (zum Beispiel Bluthochdruck) und chronisch-obstruktive Atemwegserkrankungen als „unabhängig mit Parodontitis assoziiert“ (32). Eine systematische Literaturübersicht aus dem Jahre 2022 stellt weiterhin fest, dass erfolgreiche Parodontitis-Behandlungen reduzierte „kardiometabolische“ Risiken und systemische Entzündung (Abb. 2) sowie weniger Frühgeburten zur Folge haben (33).
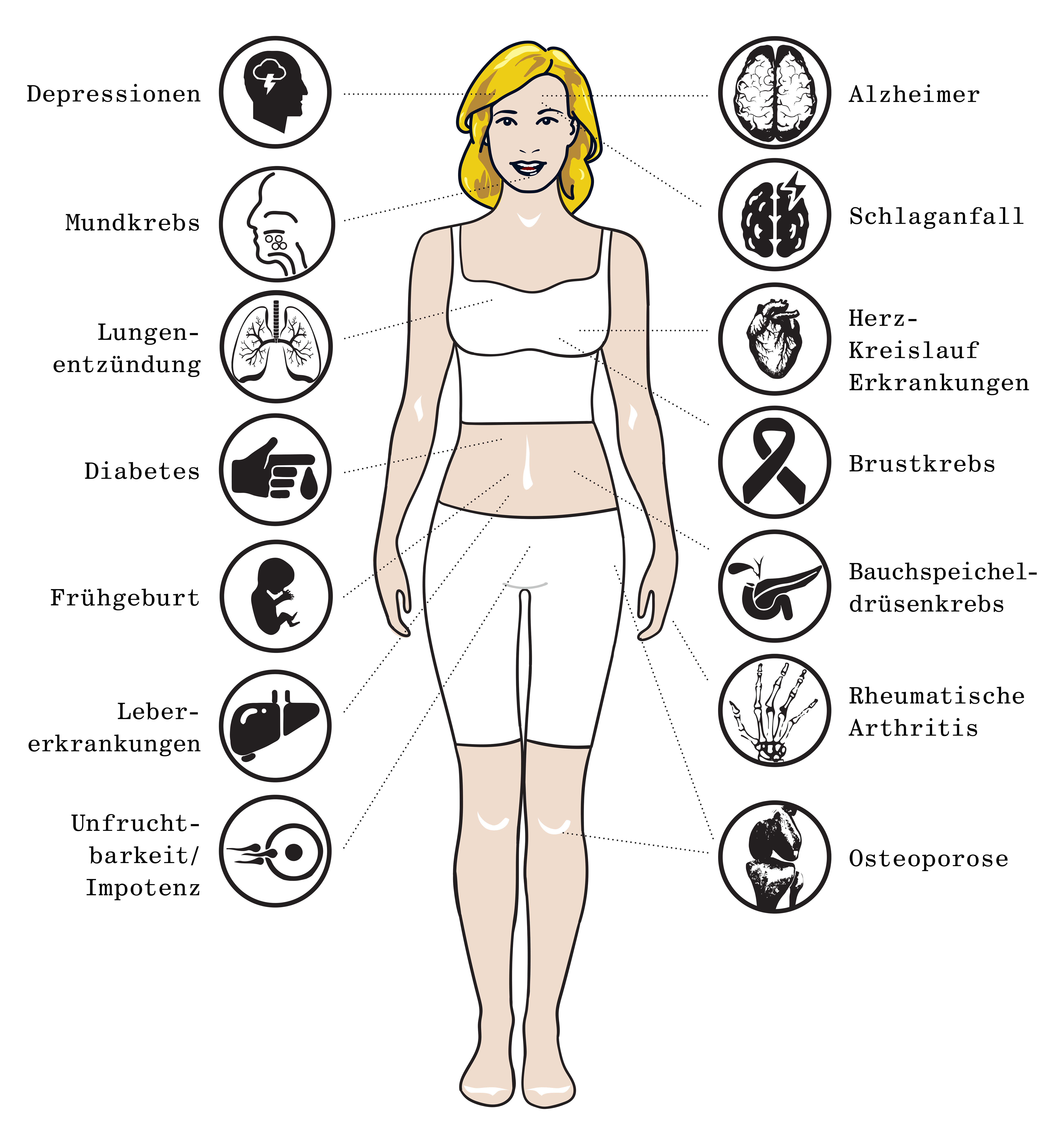
Als Indikatoren für die ersten beiden Punkte dienten veränderte Entzündungsmarker- und Blutzuckerwerte. In den hierfür ausgewerteten RCTs wurden aber nur Zeiträume von maximal sechs Monaten nachuntersucht. Klinische Endpunkte für meist nach längeren Zeiträumen auftretende kardiovaskulär bedingte Ereignisse, wie zum Beispiel Herzinfarkte oder Schlaganfälle, konnten nicht einbezogen werden. Im Folgenden werden – ohne Anspruch auf Vollständigkeit – einige Erkrankungen und Erkrankungskomplexe diskutiert, die auf unterschiedliche Weise mit oraler Dysbiose in Verbindung stehen oder für die ein Zusammenhang diskutiert wird (Abb. 3).
Kardiovaskuläre Erkrankungen und Diabetes
Als Endokarditis-Prophylaxe empfiehlt eine kardiologische Leitlinie einen sauberen Mund und bei Bedarf eine Parodontitis-Therapie (34). In Bezug auf kardiovaskuläre Erkrankungen folgert ein Cochrane-Review aus dem Jahre 2019 strenge Kriterien ebenso wie eine neuere systematische Übersicht, dass Parodontitis als kausaler Faktor aufgrund vorliegender klinischer Studien nicht gesichert ist (35, 36). In systematischen Übersichten und einem interdisziplinären Konsens-Papier europäischer Fachgesellschaften wird gute Mundhygiene und die Therapie einer manifesten Parodontitis zum Ausschluss von Risikofaktoren aber bereits empfohlen (36, 37).
Für einen sekundären Diabetes (Typ 2) zeigt eine systematische Literaturauswertung, dass eine parodontale Therapie den Glukosewert (HbA1c) nach sechs Monaten „klinisch relevant“ verbessert (38). Umgekehrt, kann Parodontitis¸ wie bereits zu Beginn der 1990er Jahre vermutet, als therapiebedürftige „Diabetes-Komplikation“ angesehen werden (Abb. 4) (39). Ein glykämisch unzureichend eingestellter Diabetes verschlechtert daher die Erfolgsaussichten einer Parodontitis-Behandlung (40, 41). Ein interdisziplinärer Austausch mit Internist oder Hausarzt ist bei beiden Erkrankungsgruppen angezeigt (32).
Fazit: Langfristige Daten für die Wirksamkeit einer Parodontitis-Therapie gegen systemische Erkrankungen sind noch rar. Das gilt auch für Herz-Kreislauf-Erkrankungen und Diabetes, wobei die Studienlage für Diabetes belastbarer ist.
Schwangerschaft und Geburt
Statistisch schwach ausgeprägte, aber von anderen Risikofaktoren unabhängige Zusammenhänge wurden auch zwischen Mundgesundheit und unerwünschtem Verlauf oder Ausgang von Schwangerschaften gefunden (42). Pathogenetisch wird unter anderem eine Infektion des Fötus oder Embryos mit pathogenen Mikroorganismen über die Plazenta diskutiert (43). Ein therapeutischer Effekt von Gingivitis- oder Parodontitis-Behandlungen konnte, wenn auch mit nur geringer Evidenzstärke, für Frühgeburten und ein reduziertes Geburtsgewicht gezeigt werden (44, 45). Wie bei Herz-Kreislauf-Erkrankungen werden zur Risikominimierung eine – möglichst bereits vorgeburtliche – gute Mundhygiene und professionelle Prophylaxe sowie bei Bedarf eine Parodontitis-Therapie empfohlen (46, 47).
Atemwegserkrankungen und Covid-19
Bei Atemwegserkrankungen, darunter chronisch-obstruktive Lungenerkrankung (COPD) und obstruktive Schlafapnoe (OSA), wurden ebenfalls Assoziationen zu Parodontitis festgestellt (48). Für Covid-19-Patienten mit Parodontitis zeigten sich erhöhte Infektions- und Sterblichkeitsrisiken (49, 50). Zwischen Mundhöhlen-Mikrobiom und akuten und chronischen Lungenerkrankungen werden weitere ätiopathologische Verbindungen diskutiert (51). Auch in diesem Bereich existieren nur wenige Interventionsstudien, die auf begrenzter Datenbasis einen positiven parodontaltherapeutischen Effekt für COPD, OSA und Asthma zeigen (52). Weiterhin lassen sich durch professionelle Mundpflegemaßnahmen oder vorgeschaltete Parodontitis-Behandlungen aspirationsbedingte Pneumonien bei hospitalisierten Patientinnen und Patienten vermeiden (52-54).
Fazit: Zur Komplikationsvermeidung im Zusammenhang mit Schwangerschaft und Geburt sind eine gute Mundhygiene und bei Bedarf parodontale Therapie angezeigt. Begrenzte Evidenz spricht für dieselben Maßnahmen bei Patientinnen und Patienten mit manifestem oder erhöhtem Risiko für Lungenerkrankungen.
Rheumatoide Arthritis und Neurodegeneration
Rheumatoide Arthritis (RA) ist eine immunologische Erkrankung, die sich in geschwollenen und geröteten Gelenken äußert und mit erhöhtem Risiko für Parodontitis verbunden ist (55). Gezeigt wurde eine verstärkte Immunantwort von RA-Patienten auf den Parodontitis-Leitkeim Porphyromonas gingivalis und eine reduzierte Aktivierbarkeit von T-Killerzellen (56). Eine systematische Übersicht zeigt als Effekt von Parodontitis-Behandlung eine reduzierte RA-Erkrankungsaktivität (57). Umgekehrt kann eine medikamentöse RA-Therapie parodontaler Entzündung entgegenwirken (58). Auch hier ist daher, wie bei anderen in diesem Beitrag genannten Erkrankungen, ein interdisziplinäres Konsil zu empfehlen (59).
Ein weiterer Komplex mit Bezug zu Parodontitis sind neurodegenerativ-demenzielle Erkrankungen wie Alzheimer und Parkinson. Auf der Basis von Tierstudien in erkranktem Hirngewebe wird oralen Mikroorganismen eine pathogenetische Rolle zugeschrieben (60, 61). Eine Querschnittsstudie mit großen Patientenkollektiven zeigt einen Zusammenhang zwischen Parodontitis und Veränderungen der weißen Hirnsubstanz (62). Beobachtungsstudien sprechen für einen Zusammenhang zwischen Stress und Depressionen mit Gingivitis und Parodontitis (7, 63, 64). Ätiologisch kommen hier und auch bei Karies eine reduzierte Immunantwort auf Mikroorganismen und damit verknüpfte pathologische Veränderungen im Sinne einer Dysbiose in Frage. Diese Annahme muss jedoch in Bezug auf Verzerrungsfaktoren, wie zum Beispiel stressbedingte Veränderungen von Ernährung oder Mundhygiene, geprüft werden (63).
Fazit: Für rheumatoide Arthritis wurde ein bidirektionaler therapeutischer Nutzen gezeigt, der für eine interdisziplinäre Zusammenarbeit spricht. Auch für neurodegenerative Erkrankungen, Stress und Depressionen sind – jeweils unterschiedliche – Verbindungen zu oralen Erkrankungen dokumentiert.
Onkologische Erkrankungen
Die ätiologische Rolle von Mikroorganismen bei onkologischen Erkrankungen ist gut dokumentiert, zum Beispiel in Bezug auf Magen- (Heliobacter pylori) und Zervixkarzinome (Papillomaviren). Analog zur Entstehung oraler Plattenepithelkarzinome könnten aus dem Mund über die Speiseröhre, die Luftröhre oder auf dem Blutweg gestreute Mikroorganismen auch im übrigen Körper eine Pathologie verursachen oder zu dieser beitragen (65, 66). Im Verdacht stehen zum Beispiel Fusobacterium nucleatum und Porphyromonas gingivalis, zwei Spezies, die auch bei Parodontitis bedeutsam sind (67). Wie im Abschnitt „Orale Entzündung als Schnittstelle“ beschrieben, könnten Mikroorganismen über immunologische Vorgänge an der Kanzerogenese beteiligt sein (30, 65, 68). Groß angelegte epidemiologische Studien zeigen bezüglich einer Korrelation zwischen Parodontitis und Krebsinzidenzen zum Teil widersprüchliche Ergebnisse (69, 70).
Unabhängig von dieser Fragestellung sollten onkologische Patienten unter Immunsuppression bereits im Vorfeld in Bezug auf Mundhygiene und parodontale Gesundheit optimal eingestellt werden (53, 71). Dazu gehört auch eine professionelle präventive Betreuung im Verlauf der Erkrankung (72). Diese wird auch bei Patienten mit Plattenepithelkarzinomen im Mund- und Rachenbereich dringend empfohlen (73).
Fazit: Wie orale Mikroorganismen an der Entstehung von Krebserkrankungen beteiligt sind, ist noch unzureichend geklärt. Immunsupprimierte onkologische und andere Patientinnen und Patienten sollten schon im Vorfeld präventiv betreut werden.
Schlussfolgerungen
Eine Dysbiose als krankhafte Verschiebung des mikrobiellen Gleichgewichts im Mund ist ein wichtiger Risikofaktor für orale, aber auch für Erkrankungen im übrigen Körper. Dazu gehören neben den aktuell am besten untersuchten Herz-Kreislauf-Erkrankungen und Diabetes mellitus zahlreiche weitere, darunter auch onkologische Erkrankungen. Um betroffene Patientinnen und Patienten erfolgreich zu behandeln, sind ein guter Kenntnisstand zu deren gesundheitlicher Vorbelastung, bestehenden anderen Risikofaktoren und bei Bedarf eine fachgerechte interdisziplinäre Zusammenarbeit notwendig.
Interessenkonflikt: Der Autor liefert seit vielen Jahren regelmäßig Textbeiträge und Beratungsleistungen an die Firmen EMS und Philips.
Dr. med. dent. Jan H. Koch
Dental Text & Consultancy Services
Parkstr. 14
85356 Freising
Tel.: 08161/42510
E-Mail: janh.koch@dental-journalist.de
www.dental-journalist.com
Literaturverzeichnis
1.Marsh PD, Zaura E. Dental biofilm: ecological interactions in health and disease. J Clin Periodontol. 2017;44 Suppl 18:S12-S22.
2.Mira A, Simon-Soro A, Curtis MA. Role of microbial communities in the pathogenesis of periodontal diseases and caries. J Clin Periodontol. 2017;44 Suppl 18:S23-S38.
3.Morou-Bermudez E, Torres-Colon JE, Bermudez NS, Patel RP, Joshipura KJ. Pathways Linking Oral Bacteria, Nitric Oxide Metabolism, and Health. J Dental Res. 2022;101:623-31.
4.Zaura E, Brandt BW, Prodan A, Teixeira de Mattos MJ, Imangaliyev S, Kool J, et al. On the ecosystemic network of saliva in healthy young adults. ISME J. 2017;11:1218-31.
5.Sanz M, Beighton D, Curtis MA, Cury JA, Dige I, Dommisch H, et al. Role of microbial biofilms in the maintenance of oral health and in the development of dental caries and periodontal diseases. Consensus report of group 1 of the Joint EFP/ORCA workshop on the boundaries between caries and periodontal disease. J Clin Periodontol. 2017;44 Suppl 18:S5-S11.
6.Baumgartner S, Imfeld T, Schicht O, Rath C, Persson RE, Persson GR. The impact of the stone age diet on gingival conditions in the absence of oral hygiene. J Periodontol. 2009;80:759-68.
7.Aggarwal K, Gupta J, Kaur RK, Bansal D, Jain A. Effect of anxiety and psychologic stress on periodontal health: a systematic review and meta-analysis. Quintessence Int. 2022;53:144-54.
8.Mumghamba EG, Manji KP, Michael J. Oral hygiene practices, periodontal conditions, dentition status and self-reported bad mouth breath among young mothers, Tanzania. Int J Dent Hyg. 2006;4:166-73.
9.Ramseier CA, Suvan JE. Behaviour change counselling for tobacco use cessation and promotion of healthy lifestyles: a systematic review. J Clin Periodontol. 2015;42 Suppl 16:S47-S58.
10.Prodan A, Brand HS, Ligtenberg AJ, Imangaliyev S, Tsivtsivadze E, van der Weijden F, et al. Interindividual variation, correlations, and sex-related differences in the salivary biochemistry of young healthy adults. Eur J Oral Sci. 2015;123:149-57.
11.Woelber JP, Gebhardt D, Hujoel PP. Free sugars and gingival inflammation: A systematic review and meta-analysis. J Clin Periodontol. 2023;50:1188-201.
12.Nibali L, Di Iorio A, Onabolu O, Lin GH. Periodontal infectogenomics: systematic review of associations between host genetic variants and subgingival microbial detection. J Clin Periodontol. 2016;43:889-900.
13.Nibali L, Di Iorio A, Tu YK, Vieira AR. Host genetics role in the pathogenesis of periodontal disease and caries. J Clin Periodontol. 2017;44 Suppl 18:S52-S78.
14.Kahharova D, Pappalardo VY, Buijs MJ, de Menezes RX, Peters M, Jackson R, et al. Microbial indicators of dental health, dysbiosis, and early childhood caries. J Dent Res. 2023;102:759-66.
15.Meyle J, Dommisch H, Groeger S, Giacaman RA, Costalonga M, Herzberg M. The innate host response in caries and periodontitis. J Clin Periodontol. 2017;44:1215-25.
16.Bamashmous S, Kotsakis GA, Kerns KA, Leroux BG, Zenobia C, Chen D, et al. Human variation in gingival inflammation. Proc Natl Acad Sci USA. 2021;30:118(27).
17.Marchesan JT, Moss K, Morelli T, Teles FR, Divaris K, Styner M, et al. Distinct microbial signatures between periodontal profile classes. J Dent Res. 2021;100:1405-13.
18.Van Dyke TE, Bartold PM, Reynolds EC. The Nexus between periodontal inflammation and dysbiosis. Front Immunol. 2020;11:511.
19.Ramseier CA, Nydegger M, Walter C, Fischer G, Sculean A, Lang NP, et al. Time between recall visits and residual probing depths predict long-term stability in patients enrolled in supportive periodontal therapy. J Clin Periodontol. 2019;46:218-30.
20.Shin YJ, Choung HW, Lee JH, Rhyu IC, Kim HD. Association of periodontitis with oral cancer: a case-control study. J Dent Res. 2019;98:526-33.
21.Bai X, Cui C, Yin J, Li H, Gong Q, Wei B, et al. The association between oral hygiene and head and neck cancer: a meta-analysis. Acta Odontol Scand. 2023;81:374-95.
22.Mauceri R, Coppini M, Vacca D, Bertolazzi G, Panzarella V, Di Fede O, et al. Salivary microbiota composition in patients with oral squamous cell carcinoma: A systematic review. Cancers (Basel) 2022;14(21):5441.
23.Zhang P, Sahingur SE, Culshaw S. Regulation of metabolism and inflammation: links with oral and systemic health: Part I Host-microbial interactions. Mol Oral Microbiol. 2024;39:27-8.
24.Abdulkareem AA, Al-Taweel FB, Al-Sharqi AJB, Gul SS, Sha A, Chapple ILC. Current concepts in the pathogenesis of periodontitis: from symbiosis to dysbiosis. J Oral Microbiol. 2023;15:2197779.
25.Hajishengallis G. Interconnection of periodontal disease and comorbidities: Evidence, mechanisms, and implications. Periodontol 2000. 2022;89:9-18.
26.Salminen A, Maatta AM, Mantyla P, Leskela J, Pietiainen M, Buhlin K, et al. Systemic metabolic signatures of oral diseases. J Dent Res. 2024;103:13-21.
27.Larvin H, Kang J, Aggarwal VR, Pavitt S, Wu J. Periodontitis and risk of immune-mediated systemic conditions: A systematic review and meta-analysis. Community Dent Oral Epidemiol. 2023;51:705-17.
28.Chavakis T, Wielockx B, Hajishengallis G. Inflammatory modulation of hematopoiesis: linking trained immunity and clonal hematopoiesis with chronic disorders. Annu Rev Physiol. 2022;84:183-207.
29.Bröker B, Schütt C, Fleischer B. Grundwissen Immunologie, 4. Aufl. Berlin, Heidelberg: Springer; 2019.
30.Baima G, Minoli M, Michaud DS, Aimetti M, Sanz M, Loos BG, et al. Periodontitis and risk of cancer: Mechanistic evidence. Periodontol 2000. 2024;96(1):83-94.
31.Nesse W, Abbas F, van der Ploeg I, Spijkervet FK, Dijkstra PU, Vissink A. Periodontal inflamed surface area: quantifying inflammatory burden. J Clin Periodontol. 2008;35:668-73.
32.Herrera D, Sanz M, Shapira L, Brotons C, Chapple I, Frese T, et al. Association between periodontal diseases and cardiovascular diseases, diabetes and respiratory diseases: Consensus report of the Joint Workshop by the European Federation of Periodontology (EFP) and the European arm of the World Organization of Family Doctors (WONCA Europe). J Clin Periodontol. 2023;50:819-41.
33.Orlandi M, Munoz Aguilera E, Marletta D, Petrie A, Suvan J, D'Aiuto F. Impact of the treatment of periodontitis on systemic health and quality of life: A systematic review. J Clin Periodontol. 2022;49 Suppl 24:314-27.
34.Delgado V, Ajmone Marsan N, de Waha S, Bonaros N, Brida M, Burri H, et al. 2023 ESC Guidelines for the management of endocarditis. Eur Heart J. 2023;44:3948-4042.
35.Liu W, Cao Y, Dong L, Zhu Y, Wu Y, Lv Z, et al. Periodontal therapy for primary or secondary prevention of cardiovascular disease in people with periodontitis. Cochrane Database Syst Rev. 2019;12:CD009197.
36.Etta I, Kambham S, Girigosavi KB, Panjiyar BK. Mouth-Heart Connection: A systematic review on the impact of periodontal disease on cardiovascular health. Cureus. 2023;15:e46585.
37.Herrera D, Sanz M, Shapira L, Brotons C, Chapple I, Frese T, et al. Periodontal diseases and cardiovascular diseases, diabetes, and respiratory diseases: Summary of the consensus report by the European Federation of Periodontology and WONCA Europe. Eur J Gen Pract. 2024;30:2320120.
38.Oliveira VB, Costa FWG, Haas AN, Junior RMM, Rego RO. Effect of subgingival periodontal therapy on glycaemic control in type 2 diabetes patients: Meta-analysis and meta-regression of 6-month follow-up randomized clinical trials. J Clin Periodontol. 2023;50:1123-37.
39.Loe H. Periodontal disease. The sixth complication of diabetes mellitus. Diabetes Care. 1993;16:329-334.
40.Sanz M, Ceriello A, Buysschaert M, Chapple I, Demmer RT, Graziani F, et al. Scientific evidence on the links between periodontal diseases and diabetes: Consensus report and guidelines of the joint workshop on periodontal diseases and diabetes by the International diabetes Federation and the European Federation of Periodontology. Diabetes Res Clin Pract. 2018;137:231-41.
41.Dommisch H, Moter A, Kuzmanova D. Parodontitis und der orale Biofilm – Von der lokalen zur systemischen Erkrankung. Quintessenz. 2020;71:1392-405.
42.Corbella S, Taschieri S, Del Fabbro M, Francetti L, Weinstein R, Ferrazzi E. Adverse pregnancy outcomes and periodontitis: A systematic review and meta-analysis exploring potential association. Quintessence Int. 2016;47:193-204.
43.Figuero E, Han YW, Furuichi Y. Periodontal diseases and adverse pregnancy outcomes: Mechanisms. Periodontol 2000. 2020;83:175-88.
44.Iheozor-Ejiofor Z, Middleton P, Esposito M, Glenny AM. Treating periodontal disease for preventing adverse birth outcomes in pregnant women. Cochrane Database Syst Rev. 2017;6:CD005297.
45.Le QA, Eslick GD, Coulton KM, Akhter R, Condous G, Eberhard J, et al. Does Treatment of gingivitis during pregnancy improve pregnancy outcomes? A systematic review and meta-analysis. Oral Health Prev Dent. 2021;19:565-72.
46.Bobetsis YA, Graziani F, Gursoy M, Madianos PN. Periodontal disease and adverse pregnancy outcomes. Periodontol 2000. 2020;83:154-74.
47.Le QA, Eslick GD, Coulton KM, Akhter R, Lain S, Nassar N, et al. Differential impact of periodontal treatment strategies during pregnancy on perinatal outcomes: A systematic review and meta-analysis. J Evid Based Dent Pract. 2022;22:101666.
48.Kuhnisch J, Zhao T, Bertelsen RJ, Jorres RA, Nowak D, Heinrich J. The impact of gingivitis reduction on lung function: a randomized trial under intensified oral hygiene. Trials. 2023;24:139.
49.Andrews M, Gao H, Datta S, Katz J. Increased odds for COVID-19 infection among individuals with periodontal disease. Clin Oral Investig. 2023;27:5925-33.
50.Larvin H, Wilmott S, Kang J, Aggarwal VR, Pavitt S, Wu J. Additive effect of periodontal disease and obesity on COVID-19 outcomes. J Dent Res. 2021;100:1228-35.
51.Mammen MJ, Scannapieco FA, Sethi S. Oral-lung microbiome interactions in lung diseases. Periodontol 2000. 2020;83:234-41.
52.Molina A, Huck O, Herrera D, Montero E. The association between respiratory diseases and periodontitis: A systematic review and meta-analysis. J Clin Periodontol. 2023;50:842-87.
53.Nozaki S, Tsutsumi Y, Takasaki Y, Yoshikawa H, Shinya T, Souta R, et al. Predictors of early postoperative pneumonia after oncologic surgery with the patients receiving professional oral health care: A prospective, multicentre, cohort study. J Perioper Pract. 2021;31:289-95.
54.Ehrenzeller S, Klompas M. Association between daily toothbrushing and hospital-acquired pneumonia: A systematic review and meta-analysis. JAMA Intern Med. 2024;184:131-42.
55.Bolstad AI, Fevang BS, Lie SA. Increased risk of periodontitis in patients with rheumatoid arthritis: A nationwide register study in Norway. J Clin Periodontol. 2023;50:1022-32.
56.Gaudilliere DK, Culos A, Djebali K, Tsai AS, Ganio EA, Choi WM, et al. Systemic Immunologic consequences of chronic periodontitis. J Dent Res. 2019;98:985-93.
57.Sun J, Zheng Y, Bian X, Ge H, Wang J, Zhang Z. Non-surgical periodontal treatment improves rheumatoid arthritis disease activity: a meta-analysis. Clin Oral Investig. 2021;25:4975-85.
58.Petit C, Culshaw S, Weiger R, Huck O, Sahrmann P. Impact of treatment of rheumatoid arthritis on periodontal disease: A review. Mol Oral Microbiol. 2024;39(4):199-224.
59.Slots J. Life-threatening pathogens in severe/progressive periodontitis: Focal infection risk, future periodontal practice, role of the Periodontology 2000. Periodontol 2000. 2020;84:215-6.
60.Salhi L, Al Taep Y, Salmon E, Van Hede D, Lambert F. How Periodontitis or periodontal bacteria can influence Alzheimer's disease features? A Systematic review of pre-clinical studies. J Alzheimers Dis. 2023;96:979-1010.
61.Parra-Torres V, Melgar-Rodriguez S, Munoz-Manriquez C, Sanhueza B, Cafferata EA, Paula-Lima AC, et al. Periodontal bacteria in the brain-implication for Alzheimer's disease: A systematic review. Oral Dis. 2023;29:21-8.
62.Mayer C, Walther C, Borof K, Nagele FL, Petersen M, Schell M, et al. Association between periodontal disease and microstructural brain alterations in the Hamburg City Health Study. J Clin Periodontol. 2023; Jun 1. doi: 10.1111/jcpe.13828.
63.Sato Y, Saijo Y, Yoshioka E. Work stress and oral conditions: a systematic review of observational studies. BMJ Open. 2021;11:e046532.
64.Cirkel LL, Jacob L, Smith L, Lopez-Sanchez GF, Konrad M, Kostev K. Relationship between chronic gingivitis and subsequent depression in 13,088 patients followed in general practices. J Psychiatr Res. 2021;138:103-6.
65.Verma UP, Singh P, Verma AK. Correlation between chronic periodontitis and lung cancer: A systematic review with meta-analysis. Cureus. 2023;15:e36476.
66.Yang Y, Long J, Wang C, Blot WJ, Pei Z, Shu X, et al. Prospective study of oral microbiome and gastric cancer risk among Asian, African American and European American populations. Int J Cancer. 2022;150:916-27.
67.Karpinski TM. Role of Oral microbiota in cancer development. Microorganisms 2019;7(1):20.
68.Calvillo-Arguelles O, Jaiswal S, Shlush LI, Moslehi JJ, Schimmer A, Barac A, et al. Connections between clonal hematopoiesis, cardiovascular disease, and cancer: A review. JAMA Cardiol. 2019;4:380-7.
69.Huang Y, Michaud DS, Lu J, Platz EA. The association of clinically determined periodontal disease and edentulism with total cancer mortality: The national health and nutrition examination survey III. Int J Cancer. 2020;147:1587-96.
70.Michaud DS, Liu Y, Meyer M, Giovannucci E, Joshipura K. Periodontal disease, tooth loss, and cancer risk in male health professionals: A prospective cohort study. Lancet Oncol. 2008;9:550-8.
71.Zhang Y, Ren X, Hu T, Cheng R, Bhowmick NA. The relationship between periodontal disease and breast cancer: From basic mechanism to clinical management and prevention. Oral Health Prev Dent. 2023;21:49-60.
72.Djuric M, Hillier-Kolarov V, Belic A, Jankovic L. Mucositis prevention by improved dental care in acute leukemia patients. Support Care Cancer. 2006;14:137-46.
73.Nishi H, Obayashi T, Ueda T, Ohta K, Shigeishi H, Munenaga S, et al. Head and neck cancer patients show poor oral health as compared to those with other types of cancer. BMC Oral Health. 2023;23:647.

