Wer über einen langen Zeitraum im Übermaß Zucker und andere Kohlenhydrate zu sich nimmt, trägt ein erhöhtes Risiko, eine bestehende Autoimmunkrankheit zu verschlimmern. Bei den Betroffenen greift das Immunsystem das körpereigene Gewebe oder ein Organ an; die Folge sind beispielsweise chronisch entzündliche Darmerkrankungen wie Morbus Crohn und Colitis ulcerosa, Typ-1-Diabetes sowie die chronische Entzündung der Schilddrüse.
Neue Angriffspunkte für eine Therapie
Die Prozesse, die in diesen Fällen auf molekularer Ebene ablaufen, sind vielschichtig und äußerst komplex. Jetzt ist es Wissenschaftlern der Julius-Maximilians-Universität Würzburg (JMU) gelungen, neue Details zu entschlüsseln. Ihre Arbeiten weisen darauf hin, dass ein übermäßiger Konsum von Kohlenhydraten die Produktion von entzündlichen Zytokinen (Botenstoffe) fördert und so die krankmachenden Funktionen bestimmter Zellen des Immunsystems be günstigt. Im Umkehrschluss könnte dies auch bedeuten, dass sich eine kalorienreduzierte Ernährung günstig auf die Immunerkrankungen auswirken kann. Die Forschungsergebnisse zeigen auch neue Angriffspunkte für eine Therapie an: Eine spezifische Blockade bestimmter Stoffwechselprozesse in diesen Immunzellen könnte die überschießenden Immunreaktionen unterdrücken.
Verantwortlich für die Studie (1) ist Dr. Martin Väth, Nachwuchsgruppenleiter am Institut für Systemimmunologie – einer Max-Planck-Forschungsgruppe unter dem Dach der JMU, in deren Fokus das Wechselspiel des Immunsystems mit dem Organismus steht. Daran beteiligt waren Teams aus Amsterdam, Berlin, Freiburg und Leuven.
Glukosetransporter mit Nebenjob
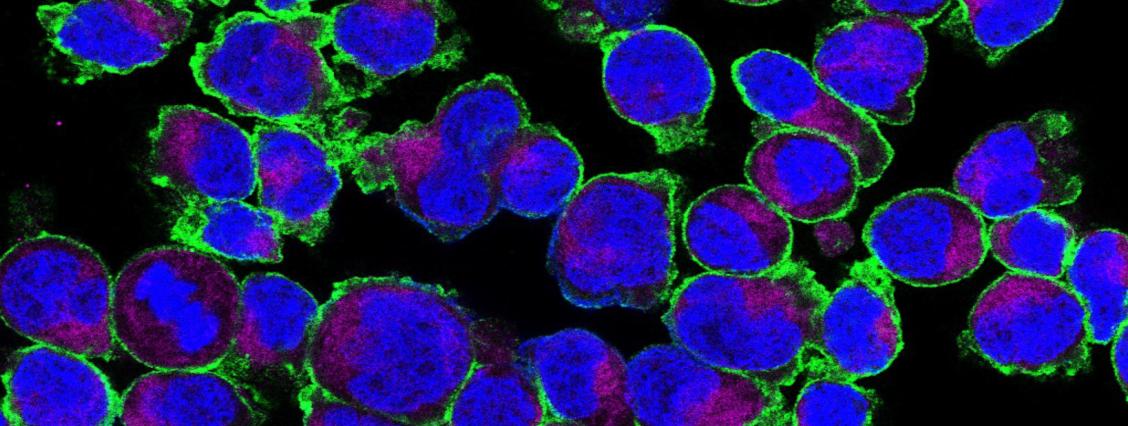
„Immunzellen benötigen große Mengen an Zucker in Form von Glukose, um ihre Aufgaben erfüllen zu können. Mithilfe spezialisierter Transporter in ihrer Zellmembran können sie diese aus der Umgebung aufnehmen“, erklärt Dr. Väth. Gemeinsam mit seinem Team konnte er jetzt zeigen, dass ein bestimmter Glukosetransporter – mit wissenschaftlichem Namen GLUT3 genannt – in T-Zellen neben der Energiegewinnung aus Zucker weitere Funktionen für den Stoffwechsel erfüllt (Abb. 1). In ihrer Studie haben sich die Wissenschaftlerer auf eine Gruppe von Zellen des Immunsystems konzentriert, die noch nicht allzu ange bekannt ist: T-Helferzellen vom Typ 17, auch Th17-Lymphozyten genannt. Von ihnen wird vermutet, dass sie eine wichtige Rolle bei der Regulierung von Entzündungsvorgängen spielen.
„Diese Th17-Zellen tragen jede Menge GLUT3-Proteine auf ihrer Zelloberfläche“, erklärt Väth. Aufgenommene Glukose wandelt sie dann in den Mitochondrien zu Zitronensäure um. Diese wird anschließend im Zellplasma zu dem Acetyl-Koenzym A umgewandelt, das unter anderem als Ausgangsstoff für die Synthese von Fettstoffen benötigt wird.
Einfluss auf entzündungsfördernde Gene
Acetyl-KoA übernimmt in Th17-Zellen aber noch mehr Aufgaben. Väth und sein Team stellten fest, dass dieses Stoffwechselprodukt auch die Aktivität verschiedener Genabschnitte im Zellkern regeln kann. Auf diese Weise nimmt es dort direkten Einfluss auf die Aktivität entzündungsfördernder Gene.
Die neuen Erkenntnisse eröffnen nach Ansicht der Forschenden Ansatzpunkte für eine zielgerichtete Therapie bei Autoimmunerkrankungen. Beispielsweise könne die Blockade der GLUT3-abhängigen Synthese von Acetyl-KoA die krankmachenden Funktionen von Th17-Zellen verhindern und dadurch entzündlich-pathologische Prozesse im Körper reduzieren. Diese „metabolische Umprogrammierung“ von T-Zellen sei ein neuer und spezifischer Angriffspunkt für die Therapie von Autoimmunerkrankungen, ohne dabei das Immunsystem komplett „ausschalten“ zu müssen.
Literaturverzeichnis:
1. Hochrein SM, Wu H, Eckstein M, Arrigoni L, Herman JS, Schumacher F, Gerecke C, Rosenfeldt M, Grün D, Kleuser B, Gasteiger G, Kastenmüller W, Ghesquière B, von den Bossche J, Abel ED, Vaeth M. The glucose transporter GLUT3 controls T helper 17 cell responses through glycolyticepigenetic reprogramming. Cell Metabolism. 2022;34:516–32. https://doi.org/10.1016/ j.cmet.2022.02.015