Prävention und Therapie einer oralen Dysbiose – Teil 2: Methoden und Konzepte

Prävention und Therapie einer oralen Dysbiose
Teil 2 – Methoden und Konzepte
Quintessenz für das Praxisteam
Parodontitis ist Folge einer subgingivalen Dysbiose, eines gestörten Gleichgewichts im Biofilm. Bei Patienten mit moderatem Risiko lässt sich diese durch effektive Mundhygiene und regelmäßige professionelle Entfernung harter und weicher Beläge im Rahmen einer professionellen Prophylaxe („PZR“) vermeiden. Bei anderen Patienten kann es notwendig sein, zusätzlich relevante Risikofaktoren zu kontrollieren und interdisziplinär mit Ärzten und Heilberuflern anderer Fachgebiete tätig zu werden, zum Beispiel mit innerer Medizin, Raucherentwöhnung und Ernährungsberatung. Kliniker haben in enger Zusammenarbeit mit einem Produktanbieter ein modular aufgebautes Protokoll für die professionelle Prophylaxe und die Therapie von Parodontitis und Periimplantitis entwickelt (Guided Biofilm Therapy). Dieses lässt sich im Sinne eines weiter gefassten ”Dysbiose-Managements” risiko-adaptiert und patientenindividuell in der täglichen Praxis umsetzen.
Zusammenfassung
Eine Dysbiose lässt sich als pathologische Interaktion zwischen Mikrobiom und Wirtsgewebe beschreiben. Die dadurch bedingten oralen Erkrankungen – vor allem Karies und Parodontitis – können durch effektive Mundhygiene und professionelle Entfernung harter und weicher Beläge in vielen Fällen vermieden werden. Bei vorhandenen Allgemeinerkrankungen oder ungünstigem Lebensstil muss zusätzlich das erhöhte individuelle Risiko kontrolliert werden. Dies gelingt durch ein integriertes oralmedizinisches Prophylaxe- und Therapiekonzept, bei Bedarf im interdisziplinären Dialog mit anderen Fachdisziplinen. Schließlich wird die Grundstruktur eines modular aufgebauten, individuell adaptierbaren und wissenschaftlich dokumentierten Konzepts erläutert, das für die Prävention und das Management dysbiosebedingter oraler Erkrankungen entwickelt wurde.
Ein integriertes klinisches Konzept
Die Zahn- und orale Medizin fokussiert seit langer Zeit auf den Risikofaktor Biofilm, der bei einer Dysbiose zum zentralen ätiologischen Faktor wird. Entsprechend wird in aktuellen Empfehlungen der parodontologischen und kariologischen Fachgesellschaften betont, dass als persönliches Biofilm-Management eine geeignete Mundhygiene erforderlich ist (1, 2). Hinzu kommt die professionelle Prophylaxe als Maßnahmenkomplex, mit dem das individuelle Risiko gesunder oder bereits therapierter Patienten kontrollierbar ist. Hier spielt die supra- und gegebenenfalls subgingivale Entfernung harter und weicher Beläge und die Behandlung plaque-retentiver Bereiche eine zentrale Rolle (1). Bestandteil eines umfassenden und damit fachgerechten Konzepts ist schließlich die Information, Instruktion und Motivation der Patienten in Bezug auf Mundhygiene und das Management von Risikofaktoren (vgl. Teil 1 dieses Beitrags, Prophylaxe Impuls Nr. 1/2025). Im Folgenden wird der jeweilige Stellenwert der genannten Maßnahmen im Hinblick auf die orale und systemische Gesundheit umrissen.
Mundhygiene
Für den Erfolg professionell durchgeführter individueller Motivationsmaßnahmen gibt es – sowohl in Bezug auf Karies, als auch Parodontitis – nur begrenzte Evidenz (3). Ein in diesem Bereich relativ neuer Ansatz ist die motivierende Gesprächsführung (4). Mängel im persönlichen Biofilm-Management beruhen einerseits auf Motivationsproblemen, andererseits auf nicht ausreichender Kompetenz der meisten Patienten bei der Mundhygiene (5). Hinzu kommt, dass sich ein wesentlicher Anteil harter und weicher Beläge in Interdentalräumen und im Sulkus befindet und nur mit geeigneten Hilfsmittel entfernbar ist, zum Beispiel mit Interdentalbürsten, Zahnseide oder gegebenenfalls oralen Irrigatoren („Mundduschen“) (5-8). Die Maßnahmen reduzieren bei richtiger Anwendung die Masse des Biofilms und seine entzündungsfördernden Eigenschaften und helfen, Sondierungsblutungen zu vermeiden.
Gute Mundhygiene muss daher als notwendige tägliche Maßnahme angesehen werden, mit der ein wichtiger Risikofaktor für orale und systemische Erkrankungen kontrollierbar ist (9-12). Für eine sichere primäre und sekundäre Prävention reicht sie aber, abhängig von vorhandenen Risikofaktoren, häufig nicht aus. Weitere Maßnahmen im Sinne eines lebenslangen personalisierten Risiko-Managements sind erforderlich (13-15).
Fazit: Mundhygiene ist eine notwendige, aber häufig nicht hinreichende Maßnahme zur Verhinderung eines dysbiotischen Biofilms als Risikofaktor für orale und systemische Erkrankungen.
Professionelle Prophylaxe – primär präventiv
Dysbiose-Vermeidung ist auch ein wichtiges Ziel professioneller Maßnahmen. Die präventive Wirksamkeit professioneller Prophylaxe einschließlich Zahnreinigung („PZR“) bei gesunden Patienten ist umstritten und es liegen für diese Maßnahme keine aussagekräftigen kontrollierten Studien vor (16). Dennoch kann aufgrund von Langzeitstudien mit großen Patientenkollektiven ein starker Effekt angenommen werden (17, 18). Dieser konnte besonders bei systematischer und persönlicher Betreuung im Rahmen eines umfassenden oralen Risikomanagements gezeigt werden (19, 20). Saubere orale Verhältnisse sind zudem notwendig, damit zum Beispiel initiale kariöse Läsionen oder Erosionen diagnostiziert werden und Patienten gute Mundhygiene betreiben können (21).
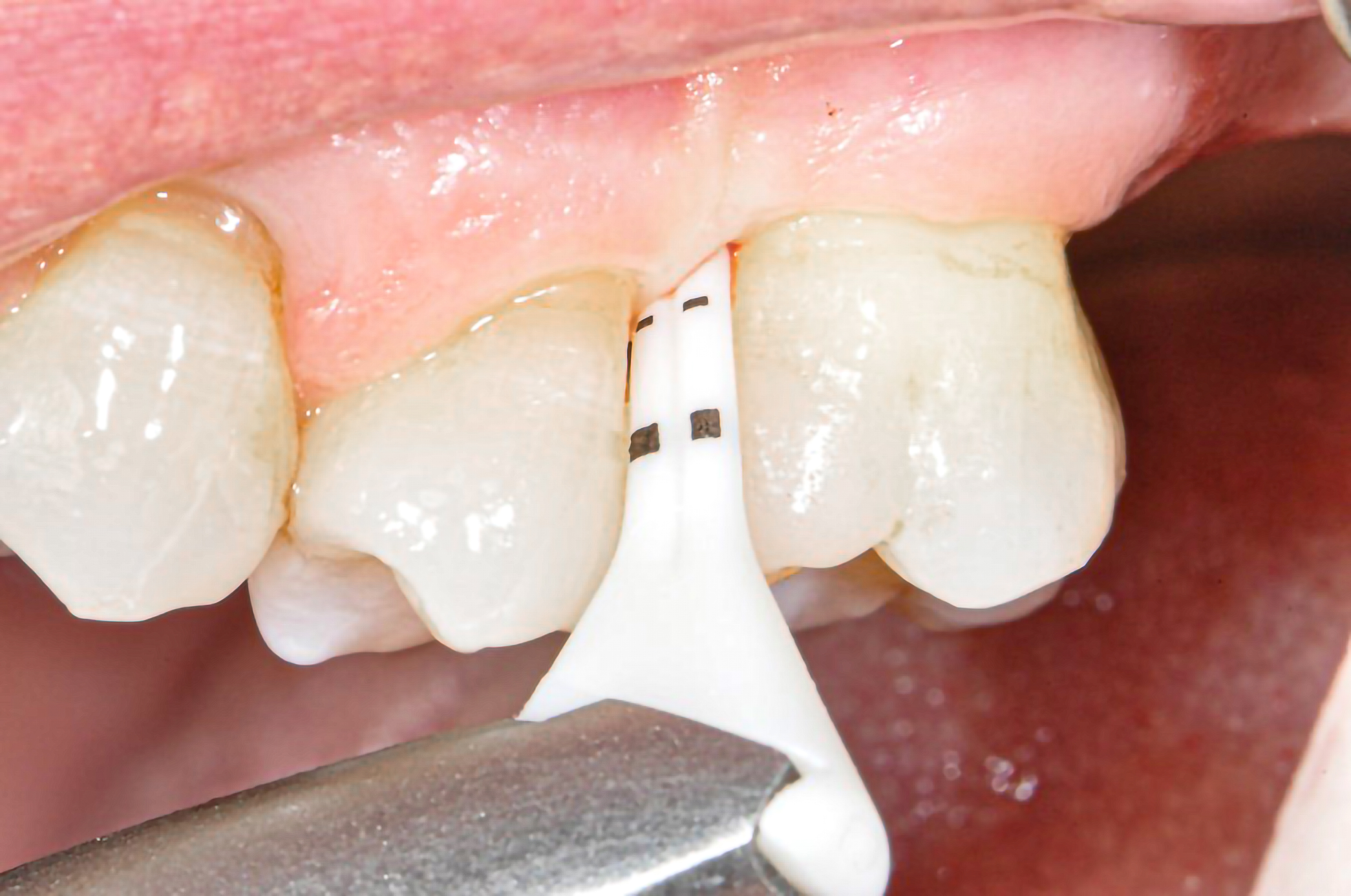
Viele Risikofaktoren, darunter ungünstige Ernährung, Rauchen und Alkohol, Bewegungsmangel und Stress, beziehen sich zugleich auf orale und andere nicht übertragbare Erkrankungen (19, 22-24). Entsprechende Maßnahmen im Rahmen der zahnärztlichen professionellen Prophylaxe, zum Beispiel Ernährungsberatung und Rauchentwöhnung (Abb. 1), sind wissenschaftlich noch unzureichend untersucht. Detaillierte Empfehlungen für professionelle Maßnahmen in der primären Prophylaxe liegen zudem, im Gegensatz zur sekundären Prophylaxe in der Parodontologie, nur für Teilbereiche wie der Kariesprävention mit Fluoriden vor (2). Wegen begrenzter risikodiagnostischer Möglichkeiten gilt das auch für die Festlegung geeigneter Recall-Intervalle (19, 25, 26).

Bezüglich Methoden für das supragingivale Biofilm-Management wurden für spezielle Luft-Wasser-Pulver-Systeme („Airflowing“) im Vergleich zum konventionellen Vorgehen mit rotierenden Bürstchen und Pasten („Politur“) gleichwertige oder bessere klinische Ergebnisse gezeigt (27-29). Mit einem systematischen, modularen Protokoll für die primäre („PZR“) und sekundäre (AIT, UPT) professionelle Prophylaxe wird nach Spülen mit antiinfektiver Lösung und Befundaufnahme (Schritt 1), obligatorischem Anfärben und Patienteninstruktion (Schritt 2, Abb. 2) zunächst der Biofilm mit speziellen Luft-Wasser-Pulver-Systemen und dann erst verbleibender Zahnstein mit piezokeramischem Ultraschall entfernt (Schritte 4 bis 6, Abb. 3-5). Die sauberen Zahnoberflächen können dann optimal untersucht und ein risiko-adaptiertes Recall-Intervall festgelegt werden (Schritte 7 und 8 der Guided Biofilm Therapy GBT, Abb. 6) (27).


Die Methode ist laut kontrollierten Studien zeitsparender und wird vom Großteil der Patienten und Anwenderinnen gegenüber der konventionellen Methode eindeutig bevorzugt (27, 29-31). Weiterhin schont Airflowing mit minimal abrasiven Pulvern, zum Beispiel auf der Basis von Glycin oder Erythritol, im Vergleich zu anderen Pulverprodukten oder Politur sowohl Zahnhartsubstanzen einschließlich freiliegendem Dentin, als auch Restaurationsoberflächen (32, 33). Das Pulver gelangt bei korrekter Anwendung bis zu 4 mm in den Sulkus und hat im Gegensatz zur konventionellen Politur günstige Effekte auf das Mikrobiom (34).
Fazit: Im Rahmen primärpräventiver professioneller Prophylaxe sollten neben dem Biofilm-Management Risikofaktoren kontrolliert werden. Für die Zahnreinigung ist Airflowing eine effektive, schonende und patientenfreundliche Methode.
Parodontitis-Therapie und sekundäre Prävention
Die Behandlung von Parodontitis basiert primär auf der effektiven Entfernung weicher (Biofilm) und harter Beläge (Zahnstein) von oralen Oberflächen (35). Dabei sollte der Biofilm als ätiologischer Faktor im Vordergrund stehen (1, 36). Die Maßnahmen führen bei den meisten Patienten sowohl in der Initial-, als auch in der nachfolgenden unterstützenden Therapie (UPT) vorübergehend zu mikrobiellen und immunologischen Veränderungen, die mit Gesundheit vereinbar sind (36-39). Auch hier sind exakte Zeiträume variabel und von individuellen Risikofaktoren abhängig (40). Das Biofilm-Management im Rahmen der Parodontitis-Therapie muss wie in der primären Prophylaxe von einem systematischen professionellen Konzept begleitet werden und ist auch bei vorbelasteten Patienten erfolgreich (Abb. 7a+b, 8a+b) (35, 39, 41). Wie in der primären Prophylaxe liegen zu Maßnahmen des Risikofaktoren-Managements in der Parodontitis-Therapie nur begrenzte Daten vor (19).
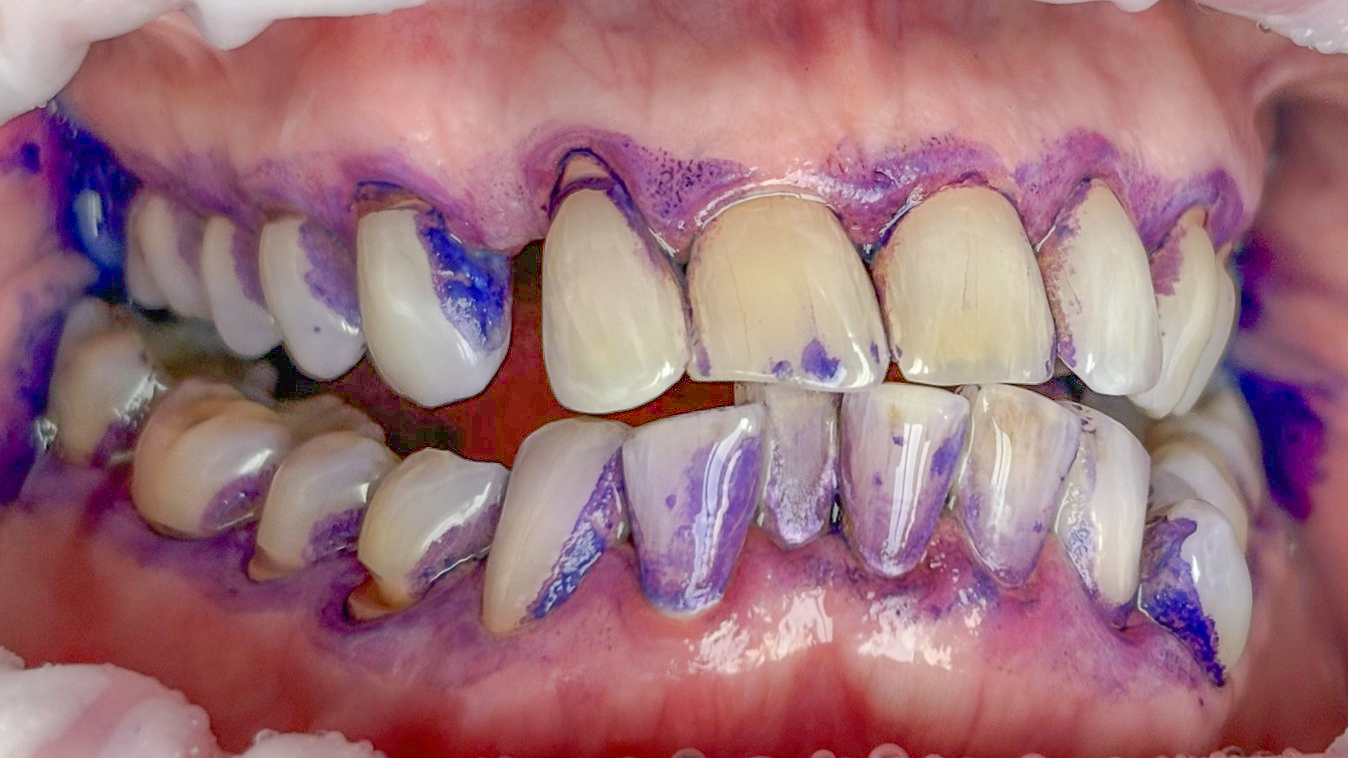
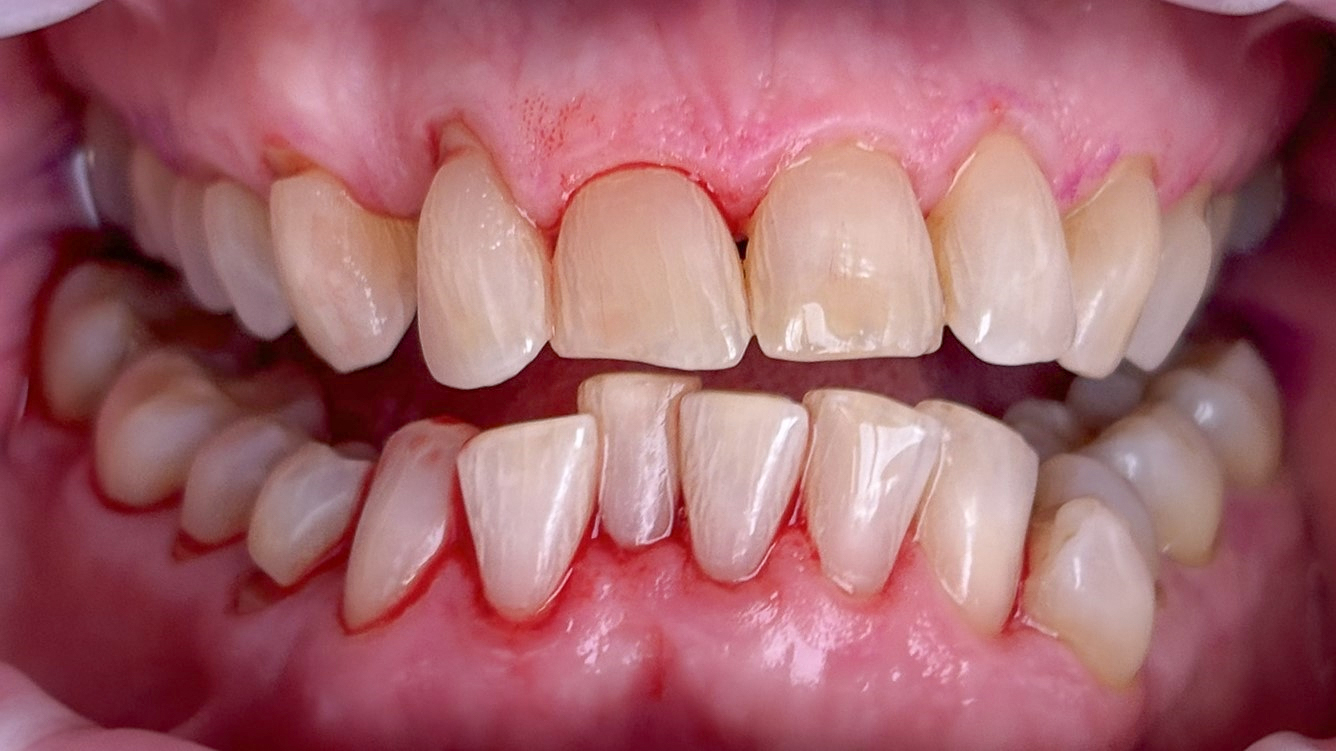
Als Standardmethoden für Biofilm-Management und Zahnsteinentfernung in der Parodontitis-Therapie gelten Hand-, Ultraschall und Schallinstrumente. Nach aktuellen Maßstäben der evidenzbasierten Medizin wurde in Bezug auf die Effektivität oder Patientenakzeptanz keine überlegene Methode identifiziert und damit auch keine Empfehlung ausgesprochen (19, 42). Für den alternativen oder zusätzlichen (adjunktiven) Einsatz von subgingivalem Airflowing unter Verwendung niedrig abrasiver Pulver wurden – allein oder in Verbindung mit speziellen piezokeramischen Ultraschallinstrumenten – in der initialen oder unterstützenden Therapie (UPT) klinische Ergebnisse gezeigt, die mit konventionellen Methoden insgesamt vergleichbar sind (43-50).
Hinzu kommen für die oben genannten Instrumente in der Regel eine bessere Patientenakzeptanz, kürzere Behandlungszeiten und eine bessere Biokompatibilität bezüglich Substanzverlust an Hartgeweben (39, 44, 47, 48, 51-54). Auch in Bezug auf das subgingivale Mikrobiom führt die Methode zu günstigen, mit konventionellen Methoden vergleichbaren Ergebnissen (38, 55). Weiterhin konnte gezeigt werden, dass unterstützend eingesetztes subgingivales Airflowing die bei der Instrumentierung erzeugte Bakteriämie reduziert und hierfür verwendetes minimal abrasives Erythritol-Pulver das Mikrobiom in Richtung Eubiose beeinflusst (55, 56). Weitere therapeutische Optionen sind die systemische und lokale Antibiose und eine Vielzahl adjuvanter Methoden. Diese werden in der aktuellen Leitlinie zur Behandlung der Parodontitis-Stadien I-III bewertet und können hier aus Platzgründen nicht abgehandelt werden (19).
Fazit: Subgingivale Belagentfernung wirkt günstig auf Mikrobiom und immunologische Parameter. Die klinische Effektivität verfügbarer Methoden ist vergleichbar, mit Unterschieden bei Patientenakzeptanz, Gewebeschonung und Effizienz.
Schlussfolgerungen
Mit einem gut koordinierten präventiven Ansatz lässt sich bei motivierten und gut informierten Patienten ein symbiotisches Mikrobiom aufrecht erhalten oder eine vorliegende Dysbiose in eine Symbiose überführen. Orale und systemische Entzündungen und zahlreiche damit verbundene Erkrankungen können so in aller Regel vermieden werden. Die orale Medizin hat hierfür auf der Ebene der professionellen Prophylaxe und insbesondere des Biofilm-Managements wirksame Konzepte entwickelt. In diesem Zusammenhang ist die Guided Biofilm Therapy das einzige Protokoll, das neben der primären auch die sekundäre Prävention oraler Erkrankungen einschließlich Periimplantitis sowie deren Therapie umfasst und das zugleich mit zahlreichen Studien zu den eingesetzten Methoden und Instrumentensystemen abgesichert ist (21, 57, 58).
Das klinische Konzept wurde bereits im Jahr 2019 von einem hochrangig besetzten Expertengremium in einem Konsenspapier vorgestellt (59). Es lässt sich risikoorientiert auf die individuellen klinischen Befunde abstimmen. Bei der Wahl von Instrumenten und Hilfsmitteln für die Entfernung harter und weicher Beläge sollten nach den Empfehlungen der Deutschen Gesellschaft für Parodontologie (DGParo) neben klinischen Endpunkten auch die Wünsche und Präferenzen von Patientinnen und Patienten berücksichtigt werden (19).
Gesundheitsökonomische Überlegungen
Mit oraler und interdisziplinär organisierter Prävention einschließlich Management von Risikofaktoren lässt sich einerseits das Erkrankungsrisiko reduzieren, andererseits die relative Chance auf eine höhere Lebenserwartung und Lebensqualität verbessern (60-62). Zugleich werden sowohl auf individueller, als auch auf gesamtgesellschaftlicher Ebene erhebliche Kosten gespart (60, 62, 63). Um die gemeinsamen Risikofaktoren von Parodontitis mit zum Beispiel Diabetes und Herz-Kreislauferkrankungen besser als bisher zu kontrollieren, ist eine Zusammenarbeit mit internistisch tätigen Kolleginnen und Kollegen sinnvoll. Ernährungsprobleme und Rauchentwöhnung lassen sich in Zusammenarbeit mit Experten bewältigen oder können von weiter gebildeten Prophylaxe-Mitarbeiterinnen oder -Mitarbeitern übernommen werden. Diese sind damit im besten Sinne oralmedizinisch tätig und leisten einen wichtigen Beitrag zur Gesamtgesundheit.
Auf der Basis von Versicherungsdaten und gesundheitsökonomischen Kalkulationen lassen sich durch orale Prävention auch Kosten für die Behandlung zum Beispiel von Diabetes signifikant reduzieren (63-65). Erschwert wird jedoch ein interdisziplinärer Austausch in Deutschland neben den begrenzten Honoraren dadurch, dass es im Rahmen der gesetzlichen Krankenversicherung keine Überweisungsmöglichkeit zwischen Oral-(Zahn-) und anderen Medizinern gibt. Zudem fehlen für eine fachgerechte Beratung in Bezug auf Risikofaktoren häufig entsprechende Kompetenzen.
Notwendig erscheint schließlich, mit bevölkerungsbezogenen Maßnahmen wie Förderung gesunder Ernährung (Verhältnisprävention) das Auftreten sowohl oraler als auch systemischer nicht übertragbarer Erkrankungen schon im Vorfeld zu vermeiden (66, 67). Im Zusammenwirken mit medizinisch-präventiven Konzepten sollte sich die Prävalenz der weit verbreiteten entzündlich-systemischen Erkrankungen im Mund und gesamten Körper auf mittlere und lange Sicht zurückdrängen lassen (15, 68, 69).
Interessenkonflikt: Der Autor liefert seit vielen Jahren regelmäßig Textbeiträge und Beratungsleistungen an die Firmen EMS und Philips.
Literaturverzeichnis
1.Tonetti MS, Chapple IL, Jepsen S, Sanz M. Primary and secondary prevention of periodontal and peri-implant diseases: Introduction to, and objectives of the 11th European Workshop on Periodontology consensus conference. J Clin Periodontol 2015;42 Suppl 16:S1-4.
2.Figuero E, Nobrega DF, Garcia-Gargallo M, Tenuta LM, Herrera D, Carvalho JC. Mechanical and chemical plaque control in the simultaneous management of gingivitis and caries: a systematic review. J Clin Periodontol 2017;44 Suppl 18:S116-S134.
3.Salzer S, Alkilzy M, Slot DE, Dorfer CE, Schmoeckel J, Splieth CH, et al. Socio-behavioural aspects in the prevention and control of dental caries and periodontal diseases at an individual and population level. J Clin Periodontol 2017;44 Suppl 18:S106-S115.
4.Arnett MC, Blue CM, Ahmann L, Evans MD, Reibel YG. Impact of Brief Motivational Interviewing on Periodontal Clinical Outcomes: A randomized clinical trial. J Dent Hyg 2022;96:13-22.
5.Weik U, Shankar-Subramanian S, Samann T, Wostmann B, Margraf-Stiksrud J, Deinzer R. "You should brush your teeth better": a randomized controlled trial comparing best-possible versus as-usual toothbrushing. BMC oral health 2023;23:456.
6.Bourgeois D, Bravo M, Llodra JC, Inquimbert C, Viennot S, Dussart C, et al. Calibrated interdental brushing for the prevention of periodontal pathogens infection in young adults - a randomized controlled clinical trial. Scientific reports 2019;9:15127.
7.Edlund P, Bertl K, Pandis N, Stavropoulos A. Efficacy of power-driven interdental cleaning tools: A systematic review and meta-analysis. Clin Exp Dent Res 2023;9:3-16.
8.Xu X, Zhou Y, Liu C, Zhao L, Zhang L, Li H, et al. Effects of water flossing on gingival inflammation and supragingival plaque microbiota: a 12-week randomized controlled trial. Clin Oral Investig 2023;27:4567-4577.
9.Chang Y, Lee JS, Lee KJ, Woo HG, Song TJ. Improved oral hygiene is associated with decreased risk of new-onset diabetes: a nationwide population-based cohort study. Diabetologia 2020;63:924-933.
10.Chang Y, Woo HG, Park J, Lee JS, Song TJ. Improved oral hygiene care is associated with decreased risk of occurrence for atrial fibrillation and heart failure: A nationwide population-based cohort study. European journal of preventive cardiology 2020;27:1835-1845.
11.Lang NP, Schatzle MA, Loe H. Gingivitis as a risk factor in periodontal disease. J Clin Periodontol 2009;36 Suppl 10:3-8.
12.Lertpimonchai A, Rattanasiri S, Arj-Ong Vallibhakara S, Attia J, Thakkinstian A. The association between oral hygiene and periodontitis: a systematic review and meta-analysis. Int Dent J 2017;67:332-343.
13.Elkerbout TA, Slot DE, Rijnen ME, van der Weijden GAF. Change in oral hygiene behaviour after non-surgical periodontal therapy - A retrospective analyses. Int J Dent Hyg 2023;21:259-271.
14.Ramfjord SP, Morrison EC, Burgett FG, Nissle RR, Shick RA, Zann GJ, et al. Oral hygiene and maintenance of periodontal support. J Periodontol 1982;53:26-30.
15.Jepsen S, Blanco J, Buchalla W, Carvalho JC, Dietrich T, Dorfer C, et al. Prevention and control of dental caries and periodontal diseases at individual and population level: consensus report of group 3 of joint EFP/ORCA workshop on the boundaries between caries and periodontal diseases. J Clin Periodontol 2017;44 Suppl 18:S85-S93.
16.Needleman I, Nibali L, Di Iorio A. Professional mechanical plaque removal for prevention of periodontal diseases in adults--systematic review update. J Clin Periodontol 2015;42 Suppl 16:S12-35.
17.Axelsson P, Nystrom B, Lindhe J. The long-term effect of a plaque control program on tooth mortality, caries and periodontal disease in adults. Results after 30 years of maintenance. J Clin Periodontol 2004;31:749-757.
18.Bastendorf KD, Laurisch L. Langzeiterfolge der systematischen Kariesprophylaxe. Dtsch Zahnärztl Zeitschr 2009;64:548-557.
19.DG PARO Deutsche Gesellschaft für Parodontologie e. V., DGZMK Deutsche Gesellschaft für Zahn- M-uK. Die Behandlung von Parodontitis Stadium I bis IIIDie deutsche Implementierung der S3-Leitlinie „Treatment of Stage I–III Periodontitis“der European Federation of Periodontology (EFP). AWMF-Registernummer: 083-043. Stand: Dezember 2020. Gültig bis: November 2025. 2021.
20.Schwendicke F, Göstemeyer G. Evidenz der "professionellen Zahnreinigung". Gesundheitsmanagement statt Waschstraße. Der Freie Zahnarzt 2021:62-64.
21.Bastendorf K, Strafela-Bastendorf N. Auf das klinische Protokoll kommt es an – PZR, UPT und GBT. Quintessenz 2020;71:1380-1389.
22.Chapple IL, Bouchard P, Cagetti MG, Campus G, Carra MC, Cocco F, et al. Interaction of lifestyle, behaviour or systemic diseases with dental caries and periodontal diseases: consensus report of group 2 of the joint EFP/ORCA workshop on the boundaries between caries and periodontal diseases. J Clin Periodontol 2017;44 Suppl 18:S39-S51.
23.Marruganti C, Romandini M, Gaeta C, Cagidiaco EF, Discepoli N, Parrini S, et al. Healthy lifestyles are associated with a better response to periodontal therapy: A prospective cohort study. J Clin Periodontol 2023;50:1089-1100.
24.Woelber JP, Reichenbacher K, Gross T, Vach K, Ratka-Kruger P, Bartha V. Dietary and Nutraceutical Interventions as an Adjunct to Non-Surgical Periodontal Therapy-A Systematic Review. Nutrients 2023;15.
25.Fee PA, Riley P, Worthington HV, Clarkson JE, Boyers D, Beirne PV. Recall intervals for oral health in primary care patients. Cochrane Database Syst Rev 2020;10:CD004346.
26.Giannobile WV, Braun TM, Caplis AK, Doucette-Stamm L, Duff GW, Kornman KS. Patient stratification for preventive care in dentistry. Journal of dental research 2013;92:694-701.
27.Mensi M, Scotti E, Sordillo A, Dale M, Calza S. Clinical evaluation of air polishing with erythritol powder followed by ultrasonic calculus removal versus conventional ultrasonic debridement and rubber cup polishing for the treatment of gingivitis: A split-mouth randomized controlled clinical trial. Int J Dent Hyg 2022;20:371-380.
28.Wolgin M, Frankenhauser A, Shakavets N, Bastendorf KD, Lussi A, Kielbassa AM. A randomized controlled trial on the plaque-removing efficacy of a low-abrasive air-polishing system to improve oral health care. Quintessence international (Berlin, Germany : 1985) 2021;52:752-762.
29.Fu JH, Wong LB, Tong HJ, Sim YF. Conventional versus comprehensive dental prophylaxis: comparing the clinical outcomes between rubber cup and air polishing and the importance of plaque disclosure. Quintessence international (Berlin, Germany : 1985) 2021;52:264-274.
30.Ratzka P, Zaslansky P, Jost-Brinkmann PG. Scanning electron microscopy evaluation of enamel surfaces using different air-polishing powders in the orthodontic setting: an in vitro study. J Orofac Orthop 2023.
31.Furrer C, Battig R, Votta I, Bastendorf KD, Schmidlin PR. Patientenakzeptanz nach Umstellung auf «Guided Biofilm Therapy». Swiss Dent J 2021;131:229-234.
32.Barnes CM, Covey D, Watanabe H, Simetich B, Schulte JR, Chen H. An in vitro comparison of the effects of various air polishing powders on enamel and selected esthetic restorative materials. The Journal of clinical dentistry 2014;25:76-87.
33.Arefnia B, Koller M, Wimmer G, Lussi A, Haas M. In Vitro Study of Surface Changes Induced on Enamel and Cementum by Different Scaling and Polishing Techniques. Oral health & preventive dentistry 2021;19:85-92.
34.Rams TE, Slots J. Effect of supragingival air polishing on subgingival periodontitis microbiota. Can J Dent Hyg 2023;57:7-13.
35.Sanz M, Baumer A, Buduneli N, Dommisch H, Farina R, Kononen E, et al. Effect of professional mechanical plaque removal on secondary prevention of periodontitis and the complications of gingival and periodontal preventive measures: consensus report of group 4 of the 11th European Workshop on Periodontology on effective prevention of periodontal and peri-implant diseases. J Clin Periodontol 2015;42 Suppl 16:S214-220.
36.Johnston W, Rosier BT, Artacho A, Paterson M, Piela K, Delaney C, et al. Mechanical biofilm disruption causes microbial and immunological shifts in periodontitis patients. Scientific reports 2021;11:9796.
37.Greenwood D, Afacan B, Emingil G, Bostanci N, Belibasakis GN. Salivary Microbiome Shifts in Response to Periodontal Treatment Outcome. Proteomics Clin Appl 2020;14:e2000011.
38.Schulz S, Stein JM, Schumacher A, Kupietz D, Yekta-Michael SS, Schittenhelm F, et al. Nonsurgical Periodontal Treatment Options and Their Impact on Subgingival Microbiota. J Clin Med 2022;11.
39.Albonni H, Alseirafi W, Tekleh H, Abo Orabi F, Alhaj M, Almasri D, et al. Clinical outcomes of using erythritol powder by means of air polishing with ultrasonic debridement in the treatment of initial periodontal pockets in hand of dental students: A split-mouth, randomized, comparative, controlled study. Part I. Int J Dent Hyg 2021;19:262-272.
40.Ramseier CA, Nydegger M, Walter C, Fischer G, Sculean A, Lang NP, et al. Time between recall visits and residual probing depths predict long-term stability in patients enrolled in supportive periodontal therapy. J Clin Periodontol 2019;46:218-230.
41.Joseph P, Prabhakar P, Holtfreter B, Pink C, Suvan J, Kocher T, et al. Systematic review and meta-analysis of randomized controlled trials evaluating the efficacy of non-surgical periodontal treatment in patients with concurrent systemic conditions. Clin Oral Investig 2023;28:21.
42.Paterson M, Johnston W, Sherriff A, Culshaw S. Periodontal instrumentation technique: an exploratory analysis of clinical outcomes and financial aspects. British dental journal 2023:1-8.
43.Nong Z, Ya Z, Zheng J, Yong X, Tao R. The efficacy of subgingival air polishing and subgingival debridement in periodontal support therapy: a meta-analysis. Evidence-based dentistry 2023;24:142-143.
44.Abdulbaqi HR, Shaikh MS, Abdulkareem AA, Zafar MS, Gul SS, Sha AM. Efficacy of erythritol powder air-polishing in active and supportive periodontal therapy: A systematic review and meta-analysis. Int J Dent Hyg 2022;20:62-74.
45.Schlagenhauf U, Hess JV, Stolzel P, Haubitz I, Jockel-Schneider Y. Impact of a two-stage subgingival instrumentation scheme involving air polishing on attachment gain after active periodontal therapy. J Periodontol 2022;93:1500-1509.
46.Divnic-Resnik T, Pradhan H, Spahr A. The efficacy of the adjunct use of subgingival air-polishing therapy with erythritol powder compared to conventional debridement alone during initial non-surgical periodontal therapy. J Clin Periodontol 2022;49:547-555.
47.Vouros I, Antonoglou GN, Anoixiadou S, Kalfas S. A novel biofilm removal approach (Guided Biofilm Therapy) utilizing erythritol air-polishing and ultrasonic piezo instrumentation: A randomized controlled trial. Int J Dent Hyg 2022;20:381-390.
48.Nascimento GG, Leite FRM, Pennisi PRC, Lopez R, Paranhos LR. Use of air polishing for supra- and subgingival biofilm removal for treatment of residual periodontal pockets and supportive periodontal care: a systematic review. Clin Oral Investig 2021;25:779-795.
49.Liu CC, Dixit N, Hatz CR, Janson TM, Bastendorf KD, Belibasakis GN, et al. Air powder waterjet technology using erythritol or glycine powders in periodontal or peri-implant prophylaxis and therapy: A consensus report of an expert meeting. Clin Exp Dent Res 2024;10:e855.
50.Stahli A, Ferrari J, Schatzmann AS, Weigel LD, Roccuzzo A, Imber JC, et al. Clinical evaluation of a novel protocol for supportive periodontal care: A randomized controlled clinical trial. J Periodontol 2024.
51.Flemmig TF, Arushanov D, Daubert D, Rothen M, Mueller G, Leroux BG. Randomized controlled trial assessing efficacy and safety of glycine powder air polishing in moderate-to-deep periodontal pockets. J Periodontol 2012;83:444-452.
52.Muller S, Huber H, Goebel G, Wimmer G, Kapferer-Seebacher I. Pain perception during debridement of hypersensitive teeth elicited by two ultrasonic scalers. Clin Oral Investig 2017;21:1559-1564.
53.Hagi TT, Klemensberger S, Bereiter R, Nietzsche S, Cosgarea R, Flury S, et al. A Biofilm Pocket Model to Evaluate Different Non-Surgical Periodontal Treatment Modalities in Terms of Biofilm Removal and Reformation, Surface Alterations and Attachment of Periodontal Ligament Fibroblasts. PloS one 2015;10:e0131056.
54.Ulvik IM, Saethre T, Bunaes DF, Lie SA, Enersen M, Leknes KN. A 12-month randomized controlled trial evaluating erythritol air-polishing versus curette/ultrasonic debridement of mandibular furcations in supportive periodontal therapy. BMC oral health 2021;21:38.
55.Hashino E, Kuboniwa M, Alghamdi SA, Yamaguchi M, Yamamoto R, Cho H, et al. Erythritol alters microstructure and metabolomic profiles of biofilm composed of Streptococcus gordonii and Porphyromonas gingivalis. Molecular oral microbiology 2013;28:435-451.
56.Zhang W, Meng Y, Jing J, Wu Y, Li S. Influence of periodontal treatment on blood microbiotas: a clinical trial. PeerJ 2021;9:e10846.
57.Shrivastava D, Natoli V, Srivastava KC, Alzoubi IA, Nagy AI, Hamza MO, et al. Novel Approach to Dental Biofilm Management through Guided Biofilm Therapy (GBT): A Review. Microorganisms 2021;9.
58.Donnet M, Fournier M, Schmidlin PR, Lussi A. A Novel Method to Measure the Powder Consumption of Dental Air-Polishing Devices. Applied Sciences 2021;11:1101.
59.Lang N, A. L, KD. B. Wissenschaftlicher Konsensus Guided Biofilm Therapy-Protokoll. Ein neues Konzept für die primäre und sekundäre Prävention. 2019.
60.Chapple ILC. Time to take gum disease seriously. British dental journal 2022;232:360-361.
61.Yu YH, Steffensen B, Chasman DI, Buring JE. Self-reported oral health is associated with systemic health outcomes and all-cause mortality. J Am Dent Assoc 2024;155:233-243 e238.
62.European Federation of Periodontology. Time to take gum disease seriously. The societal and economic impact of periodontitis. The Economist. Intelligence Unit, 2021.
63.European Federation of Periodontology. Time to put your money where your mouth is. Adressing inequalities in oral health. The Economist, 2024.
64.Ramseier CA, Manamel R, Budmiger R, Cionca N, Sahrmann P, Schmidlin PR, et al. Cost savings in the Swiss healthcare system resulting from professional periodontal care. Swiss Dent J 2022;132:764-779.
65.Thakkar-Samtani M, Heaton LJ, Kelly AL, Taylor SD, Vidone L, Tranby EP. Periodontal treatment associated with decreased diabetes mellitus-related treatment costs: An analysis of dental and medical claims data. J Am Dent Assoc 2023;154:283-292 e281.
66.World Health Organization. Political declaration of the third high-level meeting of the General Assembly on the prevention and control of noncommunicable diseases. Report by the Director-General. EXECUTIVE BOARD EB150/7, 150th session 11 January 2022, Provisional agenda item 7. 2022.
67.Strippel H. Prävention von Zahn-, Mund- und Kieferkrankheiten. In: Hurrelmann K, Richter M, Klotz T, Stock S (Hrsg.): Referenzwerk Prävention und Gesundheitsförderung. Hogrefe, 2018:227-239.
68.Eaton K, Yusuf H, Vassallo P. Editorial: The WHO Global Oral Health Action Plan 2023-2030. Community Dent Health 2023;40:68-69.
69.World Health Organization. Draft Global Oral Health Action Plan (2023–2030). Pillar 1: One billion more people benefiting from universal health coverage - EB / 152nd session Political declaration of the third high-level meeting of the General Assembly on the prevention and control of noncommunicable diseases, Report by the Director-Genera, 2023.

